■ 研究の概要
本研究室は、食品から摂取する微量元素の生理作用、薬理作用、毒作用を明らかにすることを研究目的とし、そのために、細胞から動物までの生物試料を活用し、また遺伝子工学的手法からNMRなどの化学分析の手法までを駆使する新しいサイエンスとしての「微量元素のバイオサイエンス」を確立することを目指している。金属は非常に多様な活性を有しているので、その役割を明らかにすることは、生命現象の深いレベルでの解明につながるのみならず、金属による環境汚染問題の解決、さらには金属含有医薬品の新たな活用法の開発と副作用軽減にもつながるものと期待される。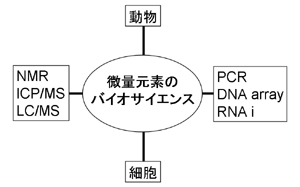
■ 研究の背景
生体を構成する元素のうち、その含量が鉄よりも少ない元素を微量元素という。環境中の微量元素は、主に食品の摂取を介して体内に取り込まれ、様々な作用を示す。生体にとって必須の微量元素を必須微量元素という。WHOは、B, Si, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Se, Mo, I をヒトにとっての必須微量元素であると認めている。一方、Cd, Hg, As, Pb などの元素は微量でも体内に蓄積すると有害な作用を示す。また、Zn, Cu, Se などの元素は、必須であると同時に、過剰に摂取すれば毒性を示すことが知られている。このように、人間の健康にとって、適正な量の微量元素を摂取することは極めて重要である。実際に、重金属の汚染によって水俣病やイタイイタイ病などの疾患が発生し、逆にセレンや亜鉛の欠乏症も人間で報告されている。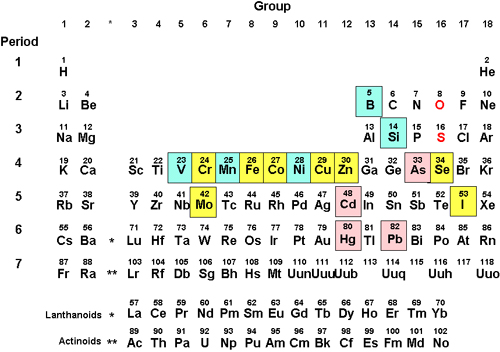
そこで、本研究室では、これらの微量元素の体内動態、生理作用、薬理作用、毒作用を、分子レベルで解明することを目指している。そのため、生化学的手法、遺伝子工学的手法のみならず、化学分析の手法も活用する。また、トキシコゲノミクス、メタボロミクス、メタロミクスなどのいわゆるオミクスの手法を微量元素研究の分野に活用しようと試みている。
■ 具体的な研究テーマ
1.カドミウム・マンガンの細胞輸送システムの解明 (→ 詳細)2.コバルトによる肝障害抑制機構の解明 (→ 詳細)
3.金属による免疫応答攪乱作用 (→ 詳細)
4.ヒ素化合物の生体内動態と毒性発現機構の解明 (→ 詳細)
5.バングラデシュヒ素汚染地域との共同研究 (→ 詳細)
6.NMRを用いたメタボロミクスの手法の確立と活用 (→ 詳細)
1.カドミウム・マンガンの細胞輸送システムの解明
イタイイタイ病発見から50年以上が経過しているにもかかわらず、Cdが細胞にどのようにして取り込まれ、また、排泄されるのか、という基本的なことが未だに解明されていない。本研究室では、この基本的な謎を解くことにより、Cdのみならず、Cdと関連するMn, Znなどの微量元素の細胞輸送機構を明らかにすることを目指している。
多くの薬物輸送体は、その薬物の耐性細胞を樹立することで発見された。しかし、これまで樹立されたCd耐性細胞すべてにおいてメタロチオネイン(金属結合タンパク質)が高発現していたため、Cd輸送についてはほとんど検討されてこなかった。そこで、我々は、メタロチオネイン欠損細胞からCd耐性細胞を樹立した。その結果、このメタロチオネイン欠損Cd耐性細胞は、Cdが蓄積しにくい=Cdが取り込まれにくいためにCd耐性を獲得していることが明らかになった。必須元素ではないCdを細胞に取り込むための輸送システムは存在しないと考えられるので、この細胞ではCd以外の必須元素の取り込みも抑制されているのではないかと予測し、20種類以上の金属の取り込みを調べた結果、Mnの取り込みも抑制されていることを発見した(Yanagiya et al. J. Pharm. Exp. Therap. 2000)。しかし、Mnの取り込み機構もよくわかっていない。そこで、Cd感受性の親株細胞とCd耐性細胞との間で遺伝子の発現レベルをmicroarrayによって比較した結果、Zn輸送体ZIP(Zrt, Irt-related protein)familyに属するZIP8、および、ZIP14の発現がCd耐性細胞において著しく低いことを発見した(Fujishiro et al. J. Health Sci. 2006)、(Fujishiro et al. J. Appl. Toxicol. 2009)。
そこで、より顕著に発現が低下していたZIP8に注目してさらに検討を進めた。ZIP8が本当にCdを取り込む能力を持っているかどうかを調べるため、ZIP8のsiRNAを親株細胞に導入すると、Cdの取り込みが減少することを見出した(Fujishiro et al. J. Appl. Toxicol. 2009)。さらに、ZIP8のmRNAレベルがCd耐性細胞で低下している原因の一部にZIP8遺伝子(Slc39a8)のメチル化の亢進が関与していることも見いだした(Fujishiro et al. Toxicol. Appl. Pharmacol. 2009)。この結果は、Cdに長期曝露された細胞におけるCd耐性獲得にエピジェネティックな調節が関与していることを示している。
一方、メタロチオネインが欠損していない通常のマウス胎芽細胞からもCd耐性細胞(A+80、B+80)を樹立し、その性状を解析した結果、やはりZIP8の発現が低下していることを見出した。(Fujishiro et al. Toxicology 2011)。このCd耐性細胞はCdのみならずMnにも耐性を示した。また、ZIP8のみならず、2価Fe輸送体であるDMT1(divalent metal transporter 1)、及び、一部の電位依存性Caチャネル(L-type CaV1.2、および、T-type CaV3.1)の発現も低下していた。
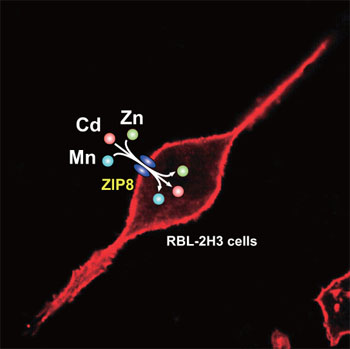
さらに、ZIP8とZIP14が本当にMn輸送にも関与しているかどうかについても検討した。我々は、ラット由来の様々な細胞の中で、好塩基球性白血病(RBL-2H3)細胞がCdに高い感受性を示すことを見出し、詳細に調べた結果、RBL-2H3細胞はMnにも高い感受性を示すこと、CdとMnの蓄積性が非常に高いことを見出した(Fujishiro et al. Metallomics 2011) 。その原因として、Cd, Mnの取り込み効率が高いことを明らかにした。そこで、ZIP8, ZIP14のsiRNAをRBL-2H3細胞に導入したところ、ZIP8のノックダウンによってのみ、CdとMnの取り込みが抑制された。以上のことから、少なくともRBL-2H3細胞においては、ZIP8がCdとMnの取り込みに重要な役割を果たしていることを明らかにした。
以上のように、様々な培養細胞、耐性細胞を用いることにより、我々は、FeやCaの輸送系に加えて、Zn輸送体の一部であるZIP8とZIP14、特にZIP8がCdとMnの取り込みに関与していることを明らかにした。現在、ZIP8、ZIP14が腎臓、小腸、脳、胎盤、赤血球でCd, Mn取り込みに実際にどのような役割を果たしているかを検討している。
2.コバルトによる肝障害抑制機構の解明
メタロチオネイン以外のCd毒性軽減因子を検索する過程で、CoCl2をCdCl2と同時にマウスに投与すると、Cdの急性毒性である肝障害を濃度依存的に抑制することを見出した。その際、肝臓中のCd濃度は変化せず、またメタロチオネインノックアウトマウスにおいても同様の作用が観察された。さらに、CoCl2の投与により、IL-6が顕著に誘導されたが、肝臓の炎症時にIL-6の下流遺伝子として誘導される急性期タンパク質であるserum amyloid Aの発現は、逆にCoによって強く抑制された。
Cd以外の肝障害誘発物質に対してもCoが抑制作用を示すかどうかを検討するため、LPS, acetaminophen, concanavarin Aなどの作用機序の異なる肝障害誘発物質を用い、CoCl2の効果を検討した。その結果、いずれのモデルにおいても、Coが濃度依存的に肝障害を抑制した。また、microarrayを用いた検討により、マウスにCoCl2を投与して1−3時間という早い時期にinterferron関連の遺伝子の発現が活性化されることも見出している(Matsumoto et al. J. Tox. Sci. 2010)。Coによる肝障害抑制機構を明らかにすることができれば、Coの新たな薬理作用を発見できる可能性がある。
3.金属による免疫応答攪乱作用これまでに、我々は3価のセリウム(CeCl3)(Kobayashi et al. Biol Pharm Bull. 2005)、5価のバナジウム(NH4VO3)(Kobayashi et al. Toxicology 2006)、および2価のマンガン(MnCl2)(Kobayashi et al. J Pharmacol Exp Ther. 2007)の3つの金属化合物に注目し、MT誘導にIL-6が深く関与していることを見出した。
特に、Mnについては、IL-6ノックアウトマウスにMnCl2を投与してもまったくMTが誘導されないことを見出し、Mnという金属によるMT誘導が完全にIL-6の産生にのみ依存していることを明らかにした。さらに、Mnは肝臓でIL-6を誘導することにより、亜鉛輸送体のZIP14の発現を亢進させ、肝臓へのZnの流入を促進し、これがMTの合成をさらに加速することも明らかにした。
一方、マウス腹腔マクロファージにLPSを作用させるとiNOSが誘導されて、NO産生が起こることが知られている。我々は、LPSによるNO産生を促進、あるいは抑制する金属をスクリーニングしたところ、亜ヒ酸がLPSによるNO産生を抑制することを見出した。しかし、LPSによるサイトカイン産生は影響を受けなかった。現在、その機構について詳細に検討中である。
また、亜ヒ酸によるマスト細胞に対する影響を検討するため、マスト細胞のモデルであるRBL-2H3細胞の脱顆粒能力、遺伝子発現の変化を検討した。その結果、低濃度の亜ヒ酸への曝露によってマスト細胞の脱顆粒能力が低下することを見出した。また、microarrayによる解析の結果から、免疫応答に重要な役割を果たすS100A8, A9の発現が亜ヒ酸によって顕著に誘導されることが明らかになった(Shimizu et al. J Tox. Sci. 2011)。現在、この機構と意義を検討中である。
これまで、ヒ素の解毒経路として、無機ヒ素化合物のメチル化が重要であると考えられてきた。しかし、近年、メチル化ヒ素化合物の中で、Asが3価の状態でいるメチル化 As(III)化合物(MMAsIII、DMAsIII)は極めて強い毒性を示すことがわかってきた(下図)。
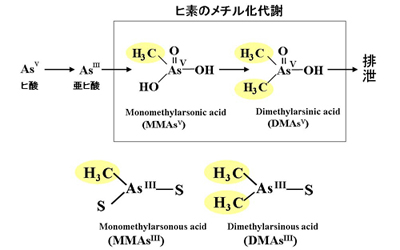
しかし、実際に生体内でのメチル化As(III)化合物の代謝、毒性を調べることは困難であった。櫻井助教授を中心とする本研究室のヒ素研究チームは、glutathioneあるいはcysteineと、MMAsIIIあるいはDMAsIIIとの複合体を簡便に合成、分離、精製する手法を開発した。さらに、これらの複合体がメチル化As(III)化合物の代謝、毒性の研究に利用可能であることを示し、実際にその毒性と細胞への取り込み機構を明らかにした(Sakurai et al. Br J Pharmacol. 2006; Kojima et al. Biol. Pharm. Bull. 2006)。
残念極まりないことに、櫻井助教授は、2006年9月15日、学会出張先の倉敷市のホテルで脳内出血のために急逝した。しかし、2009年4月から筑波大学医学部から角大悟准教授が着任し、新たなヒ素研究を展開し始めている。
現在、角大悟准教授を中心に、心臓におけるヒ素の代謝と毒性発現機構の解明、ヒ素による免疫攪乱作用の機構解明、亜ヒ酸製剤の新たな疾病への適用拡大に関する実験を進めている。急性前骨髄性白血病の治療薬として亜ヒ酸製剤が用いられているが、最も重大な副作用は心臓におけるQT延長などの毒性である。そこで、心臓由来の細胞であるH9c2を用いて、亜ヒ酸に対する応答を肝臓由来細胞と比較した結果、心臓ではNrf2の活性化が非常に弱いことを明らかにした(Sumi et al. Arch. Toxicol. 2011)。
5.バングラデシュヒ素汚染地域との共同研究現在、バングラデシュ、インド東部(西ベンガル州)、カンボジア、ベトナム、内モンゴル、台湾などのアジア各地で地下水のヒ素汚染による健康被害が重大な問題となっている。特にバングラデシュでは、河川水からの経口感染症対策として、世界中からの援助によって数多くの井戸を掘って清澄な水を得ることができたが、その地下水がヒ素で汚染されていたため、現在、5000万人以上の人々がヒ素に汚染された井戸水を摂取している。また、井戸水に代わる上水源も困難な状況である。
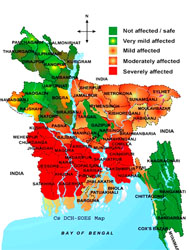
|

|
| 赤・オレンジの部分がヒ素汚染地域 | 今も使われる井戸水 |
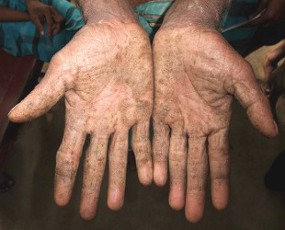
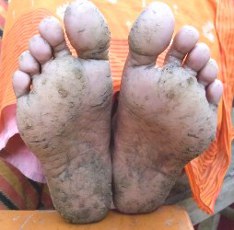
| 
|
| 手のひらの症状 | 足の裏の症状 |
本研究室は、バングラデシュ北西部のRajshahi(ラッシャイ)大学のHossain博士との共同研究により、バングラデシュ西部におけるヒ素汚染地域での健康被害の実態把握、ヒ素の曝露指標としての毛髪、爪、尿の評価、新たなインディケーターの探索を行っている。これまですでに共同研究の成果として複数の学術論文(Ali, N. et al. Environ. Health 2010; Karim M.R. et al. Sci. total Environ. 2010; ; Islam K. et al. Environ Health 2011)を報告している。 6.NMRを用いたメタボロミクスの手法の確立と活用
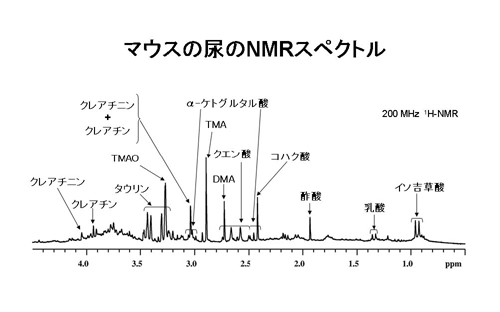
尿中の低分子化合物、代謝物の存在量と出現パターンを、NMRを用いて一斉分析するメタボロミクスの手法が確立されつつある。しかし、ほとんどの研究はラットの尿を用いて行われている。我々は、マウスの尿を用いてNMR解析する手法を確立した(下図)。
その過程で、マウスの尿はpHの変化が激しく、また、pHの変化に相関してクエン酸のchemical shiftが著しく変動することを見出した(Miyataka et al. Biol. Pharm. Bull., 30(4): 667-670 (2007) )。
さらに、マウスの尿をNMRで解析することにより、ラットやヒトではほとんど検出されないtrimethylamine(TMA)がマウスの尿中に多く排泄されることを見出した。TMAの排泄量はオスで顕著に高いこと、TMAを代謝する酵素であるflavin monooxygenase 3(FMO3)の発現に著しい雌雄差があること、肝臓におけるFMO3の活性、mRNAレベルと尿中へのTMA排泄量の間に明らかな逆相関関係があることを見出している。
■ 外部資金導入実績 (H15〜)
■科学研究費- 挑戦的萌芽研究 (平成26−27年度)
「環境化学物質の毒性に関わる選択的スプライシングの解析」
角 大悟(代表) - 基盤研究C (平成24−26年度)
「カドミウムおよびマンガンの標的臓器における金属輸送機構の解析」
藤代 瞳(代表) - 挑戦的萌芽研究 (平成24−25年度)
「ヒ素の毒性発現を規定するヒ素メチル基転移酵素の選択的スプライシング」
角 大悟(代表) - 基盤研究B (平成24−26年度)
「慢性ヒ素中毒における免疫機能障害の関与に関する研究」
角 大悟(代表) - 科研費 基盤研究B(海外学術調査) (平成24−26年度)
「東アジアのヒ素汚染地域住民におけるヒ素毒性修飾因子に関する研究」
姫野誠一郎(代表)、角 大悟(分担)、宮高透喜(分担) - 挑戦的萌芽研究 (平成23−24年度)
「ヒ素毒性の新しいメディエーターとしてのS100A8/A9タンパク質」
姫野誠一郎(代表) - 基盤研究B (平成22−24年度)
「重金属類による免疫応答攪乱作用に関する研究」
姫野誠一郎(代表)、角 大悟(分担)、宮高透喜(分担)、藤代 瞳(分担) - 若手研究B (平成22−23年度)
「亜ヒ酸製剤とレチノイン酸の併用療法への適用を目指した研究」
角 大悟(代表) - 若手研究B (平成22−23年度)
「神経細胞におけるマンガン輸送機構の解明」
藤代 瞳(代表) - 基盤研究B (平成19−21年度)
「OMICSの手法を活用した金属毒性と輸送機構の解析」
姫野誠一郎(代表)、宮高透喜(分担)、藤代 瞳(分担) - 若手研究B (平成20−21年度)
「カドミウムの細胞輸送における亜鉛輸送体とカルシウムチャネルのクロストーク」
藤代 瞳(代表) - 萌芽研究 (平成18−19年度)
「糖尿病の進展に及ぼすカドミウムの影響」
姫野誠一郎(代表) - 特別研究員奨励費 (平成18−19年度)
「トキシコゲノミクスの手法を応用した環境汚染物質に対する防御因子の検索と機構の解明」
姫野誠一郎(代表)、干 佳明(分担) - 基盤研究C (平成18年度)
「環境汚染化学物質(ヒ素)の曝露による糖尿病発症メカニズムの解析とその予防法の構築」
櫻井照明(代表) - 若手研究B (平成17−18年度)
「メタロチオネイン欠失細胞を用いたカドミウム輸送系の分子メカニズムの解析」
藤代 瞳(代表) - 基盤研究C (平成15−16年度)
「金属化合物によるサイトカイン誘導の機構とその意義」
姫野誠一郎(代表)
- イタイイタイ病及び慢性カドミウム中毒に関する総合的研究 (平成25−27年度)
「カドミウムの代謝と毒性に関与する金属輸送体の役割の解明」
姫野誠一郎(代表) - イタイイタイ病及び慢性カドミウム中毒に関する総合的研究 (平成22−24年度)
「カドミウム耐性、および輸送に関わる因子の同定と性状解析」
姫野誠一郎(分担) - イタイイタイ病及び慢性カドミウム中毒に関する総合的研究 (平成19−21年度)
「カドミウム耐性、および輸送に関わる因子の同定と性状解析」
姫野誠一郎(分担) - 重金属等の健康影響に関する総合研究 (平成16−18年度)
「カドミウム耐性、および輸送に関わる因子の同定と性状解析」
姫野誠一郎(分担)
- 平和中島財団「アジア地域重点学術研究助成」 (平成23年度)
「アジア各地のヒ素汚染地域における健康影響の地域差、個人差の要因の解明」
姫野誠一郎(代表) - 住友財団環境研究助成 (平成20−21年度)
「ヒ素化合物に対する感受性を決定するヒト尿中因子の検索」
姫野誠一郎(代表)
■ 薬学部年報(衛生化学分)
- 2010年度年報 [PDF] 660kB
- 2009年度年報 [PDF] 311kB
- 2008年度年報 [PDF] 376kB
- 2007年度年報 [PDF] 464kB
- 2006年度年報 [PDF] 137kB


