-
生体分子構造・メカニズム
我々が生きて活動している時には、タンパク質や核酸(DNA、RNA)などの生体分子が働いています。裏を返せば、タンパク質や核酸(DNA、RNA)の働きによって、我々の生命活動が担われているのです。つまり、我々が歩いたり、物を見たり、考えたりという活動も全て、生体分子の働きによって実現されているということです。ただここで考えてみてください。一般に「働く」というと、人が働くイメージを持つと思いますが、体の中で働いているのは人ではなく、生体"分子"、とどのつまり"分子"です。当たり前のことですが、分子には手も足も目もないだけでなく、考える頭もありません。この、目のない分子が自ら働くべき場所を見つけ出し、口もないのに臓器や細胞に指示を出し、生体の動きや働きを実現しているといういうことです。これはとても不思議なことです。そこで、生体分子がどのようにして (How?) 複雑な生体の動きや働きをコントロールしているのか?という不思議に我々は挑んでいます。
ではここで、分子が働くというのはどういうことでしょうか?上で述べたように、分子には目も手も頭もないので、自然界の法則(物理法則や化学的性質)に従います。つまり、「分子がその性質(化学的性質)にしたがって、あるがまま(物理法則通り)に動くと、生体機能の発現に必要な動き(働き)を"自動的"にしてしまう」と考えなければ説明ができません。また特定の機能を発揮するためには、その機能に適した形があります(例えば、車輪は円い形をしている必要があります)。したがって、我々はタンパク質や核酸(DNA、RNA)の三次元構造と化学的性質を調べて、これらの生体高分子が、どのようにして (How?) 機能を発揮できているのか?、なぜ (Why?) その構造と化学的性質が合わさると自然に機能が発現されるのか?、そのメカニズムを解明しています。なお具体的なメカニズムの解析対象は以下の通りです。
損傷塩基修復酵素hOGG1による塩基除去反応機構の研究
我々の遺伝子は、外的環境のストレス要因によって、常に損傷を受け続けています。この状態を放置すると、がんや遺伝病を引き起こすことになります。幸いにも生体には、これらの脅威に対抗して、損傷した遺伝子を直す働きを持った遺伝子修復酵素が存在します。我々は、遺伝子修復酵素の中でも損傷塩基8-oxoguanineを除去修復する修復酵素OGG1の触媒機構の解明に挑んでいます。具体的には、OGG1の三次元構造を決定し、その構造に基づいて、触媒活性の発現機構を理解しようと試みています。
ハンマーヘッド型リボザイムのRNA鎖切断機構の研究
ゲノムDNAに書き込まれた遺伝情報が発現する際には蛋白質とRNAがともに働いています。その過程では酵素機能を有したRNA分子(リボザイム)や、遺伝子の翻訳制御を行うRNA分子が関与しています。我々のグループではこのような生理機能を有したRNA分子がどのようにして機能を発揮しているのかを調べる研究を行っています。これらの機能性RNA分子は、蛋白質と同様に特異的三次元構造を形成して機能を発揮するため。機能性RNA分子の三次元構造を調べることでその生理機能発現機構を理解しようと試みています。(関連研究:ハンマーヘッド型リボザイムの金属イオン結合モチーフと二価金属イオン相互作用の研究)
遺伝子治療薬の開発と細胞内デリバリーシステムの研究
DNA二重らせん分子内における金属を介した塩基対形成の構造研究
-
ハンマーヘッド型リボザイムの金属イオン結合モチーフと二価金属イオン相互作用の研究
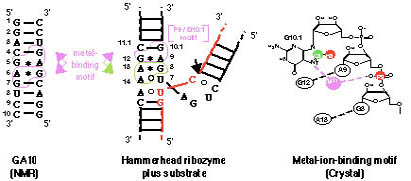
Hammerhead Ribozymeは生理条件下で金属酵素と考えられており、金属との相互作用の研究はメカニズムの解明に不可欠である。Hammerhead Ribozymeの結晶構造解析の結果より、二価金属イオンと結合できるモチーフが見つかってきている。しかし、この二価金属結合モチーフが溶液中でも実際に機能しうるかどうかは確認されていない。そこで、溶液中でのこのモチーフの金属結合能等の溶液物性を明らかとすることを目的として、以下の実験を行った。金属結合モチーフとして必要最小限の塩基配列を含むRNAオリゴマー(GA10: rGGACGAGUCC)を化学合成した。次に、種々のMgCl2濃度でGA10のNMRスペクトル(1D 15N NMR, natural abundance 1H-13C HSQC, and 1H-31P HMQC NOESY spetctra)を測定し、1H, 15N, 13C, 31Pの化学シフト値の推移をモニターした。その結果、結晶構造から推定される二価金属結合部位(N7(G10.1), C8(G10.1), H8(G10.1), P(A9))のシグナルが選択的に摂動を受けたことより、1) 二価金属結合モチーフが溶液中でも実際に機能しうる、2モチーフはリボザイムの他の保存配列がなくても独立して機能しうる、ということが明らかとなった。
次に結合した金属イオンが配位結合しているかどうかを詳細に検討した。ある時期、このモチーフに結合した金属イオンがHammerhead Ribozymeの活性中心の金属ではないかという仮説が提唱されたことがある。したがって、この金属イオンの配位子が全て水分子であるか、グアノシンの7位窒素原子が配位結合しているのかは、金属イオンの化学的性質(触媒活性の有無の評価)を知る上で必須の化学情報であった。その結果、金属イオン結合モチーフのグアノシン(G10.1)の7位窒素原子がCd(II)に配位結合していることが判った。その様な結論に至った理由は次の通りである。我々の実験で得られた金属イオン結合モチーフの15N NMRスペクトルの化学シフト値を過去のデータ(配位結合性化合物であるDMSO溶媒中でのグアノシン-Hg(II)複合体の15N NMR化学シフト値変化のデータ)と比較したところ、配位結合性化合物に相当する化学シフト値変化が見られたことがわかった。水溶液中で核酸-金属相互作用で配位結合と、配位水を介した水素結合による結合を区別した、世界で初めての研究例となった。
関連論文
Yoshiyuki Tanaka* and Kazunari Taira, Detection of RNA nucleobase metalation by NMR spectroscopy, Chemical Communications, (2005) 2069-2079.
Yoshiyuki Tanaka*, Yasuhiro Kasai, Shunsuke Mochizuki, Akihiro Wakisaka, Eugene H. Morita, Chojiro Kojima, Atsushi Toyozawa, Yoshinori Kondo, Masumi Taki, Yasuomi Takagi, Atsushi Inoue, Kazuhiko Yamasaki and Kazunari Taira*, Nature of the chemical bond formed with the structural metal ion at the A9/G10.1 motif derived from hammerhead ribozymes, Journal of the American Chemical Society, 126, 744-752 (2004).
Yoshiyuki Tanaka, Chojiro Kojima, Eugene H. Morita, Yasuhiro Kasai, Kazuhiko Yamasaki, Akira Ono, Masatsune Kainosho, and Kazunari Taira*, Identification of the Metal Ion Binding Site on an RNA Motif from Hammerhead Ribozyme using 15N-NMR Spectroscopy, Journal of the American Chemical Society, 124, 4595 -4601 (2002).
Ken-ichi Suzumura, Koichi Yoshinari, Yoshiyuki Tanaka, Yasuomi Takagi, Yasuhiro Kasai, Masaki Warashina, Tomoko Kuwabara, Masaya Orita, and Kazunari Taira*, A Reappraisal, Based on 31P NMR, of the Direct Coordination of a Metal Ion with the Phosphoryl Oxygen at the Cleavage Site of a Hammerhead Ribozyme, Journal of the American Chemical Society, 124, 8230-8236 (2002).
Yoshiyuki Tanaka, Eugene H. Morita, Hidenori Hayashi, Yasuhiro Kasai, Toshiyuki Tanaka, and Kazunari Taira*, Well-conserved tandem G-A pairs and the flanking C-G pair in hammerhead ribozymes are sufficient for capture of structurally and catalytically important metal ions, Journal of the American Chemical Society, 122, 11303-11310 (2000).
Yoshiyuki Tanaka* and Kazunari Taira*, Detection of RNA metallation by heteronuclear multidimensional NMR spectroscopy, Recent Research Developments in Organic Chemistry, vol. 9, 93-118, Transworld Research Network, India (2005).